Zum Thema "Proteine" zunächst mal ein Tafelaufschrieb des Lehrers vom 9. Januar 2015:
|
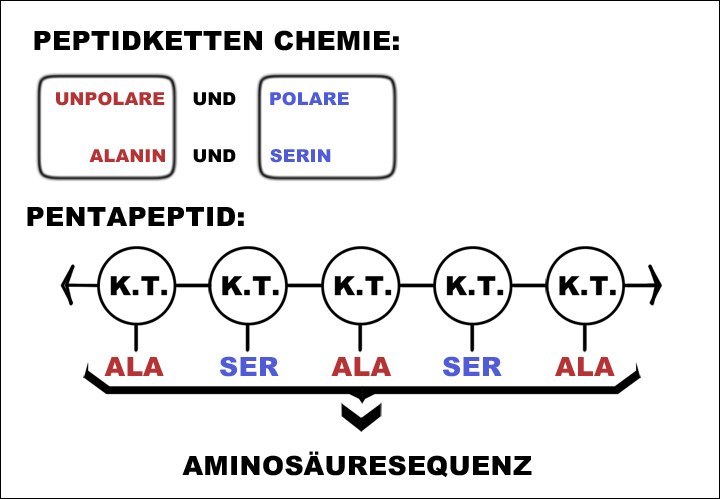
Und hier Eigentexte von Christoph Mennel aus früheren Stunden. Sie sind für die Klassen 10 und 11 = 1 und 2 am Abendgymnasium etwas zu umfangreich. Umgekehrt gesehen: Hier ist alles drin. Für Sie gibt es am Ende der Seite den Auftrag, eine Eigenzeichnung anzufertigen. Grundlegendes über Aminosäuren. Zum Aufbau der Proteine sind nur 20 verschiedene AS erforderlich. Sie werden dreibuchstabig abgekürzt. Sieben AS als Beispiele: Alanin Ala (hydrophob) Serin Ser (hydrophil) Asparaginsäure Asp (sauer) Lysin Lys (basisch) Glycin Gly (einfachst gebaut) (Buch S. 46) Cystein Cys (mit Schwefelatom) Phenylalanin Phe (hydrophob) (Buch S. 47) Wegen der Peptidbindung zwischen den AS spricht man von "Dipeptid" bei zwei verknüpften AS, von Polypeptid bei 3 bis 99 verknüpften AS, und von Protein, wenn mehr als 100 AS miteinander verknüpft sind.
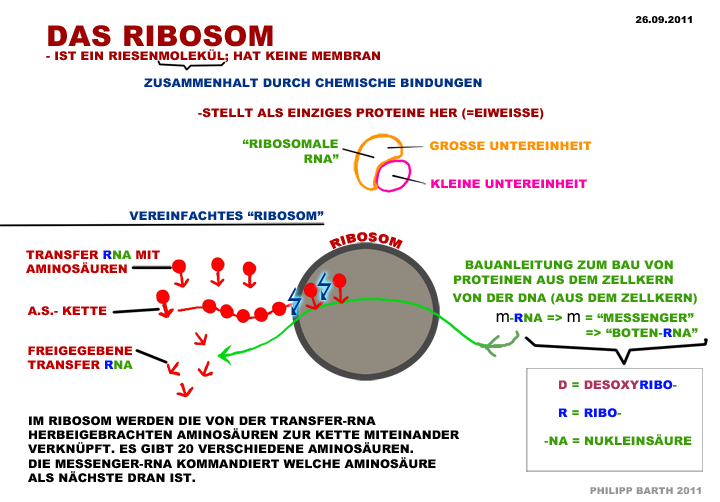
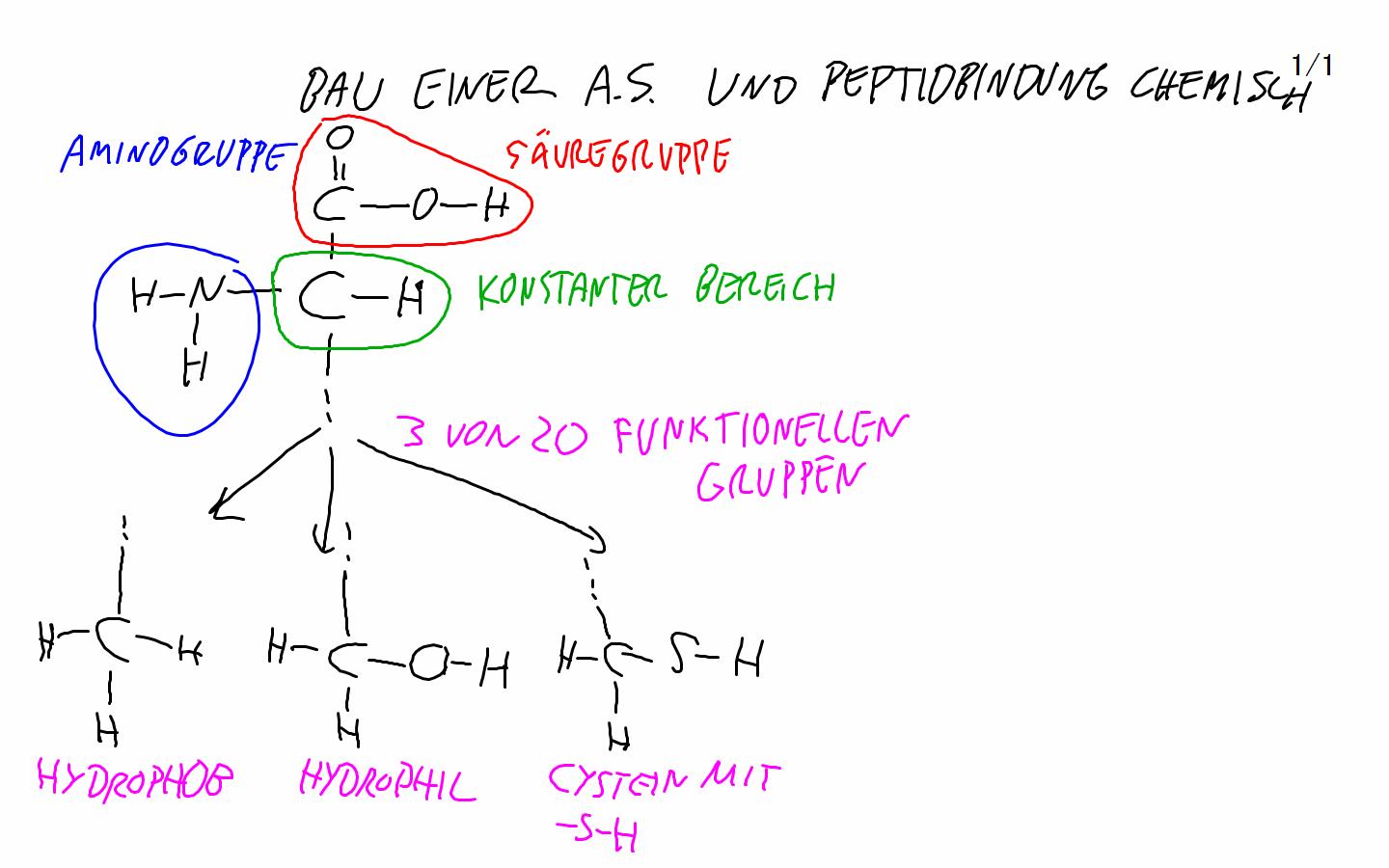
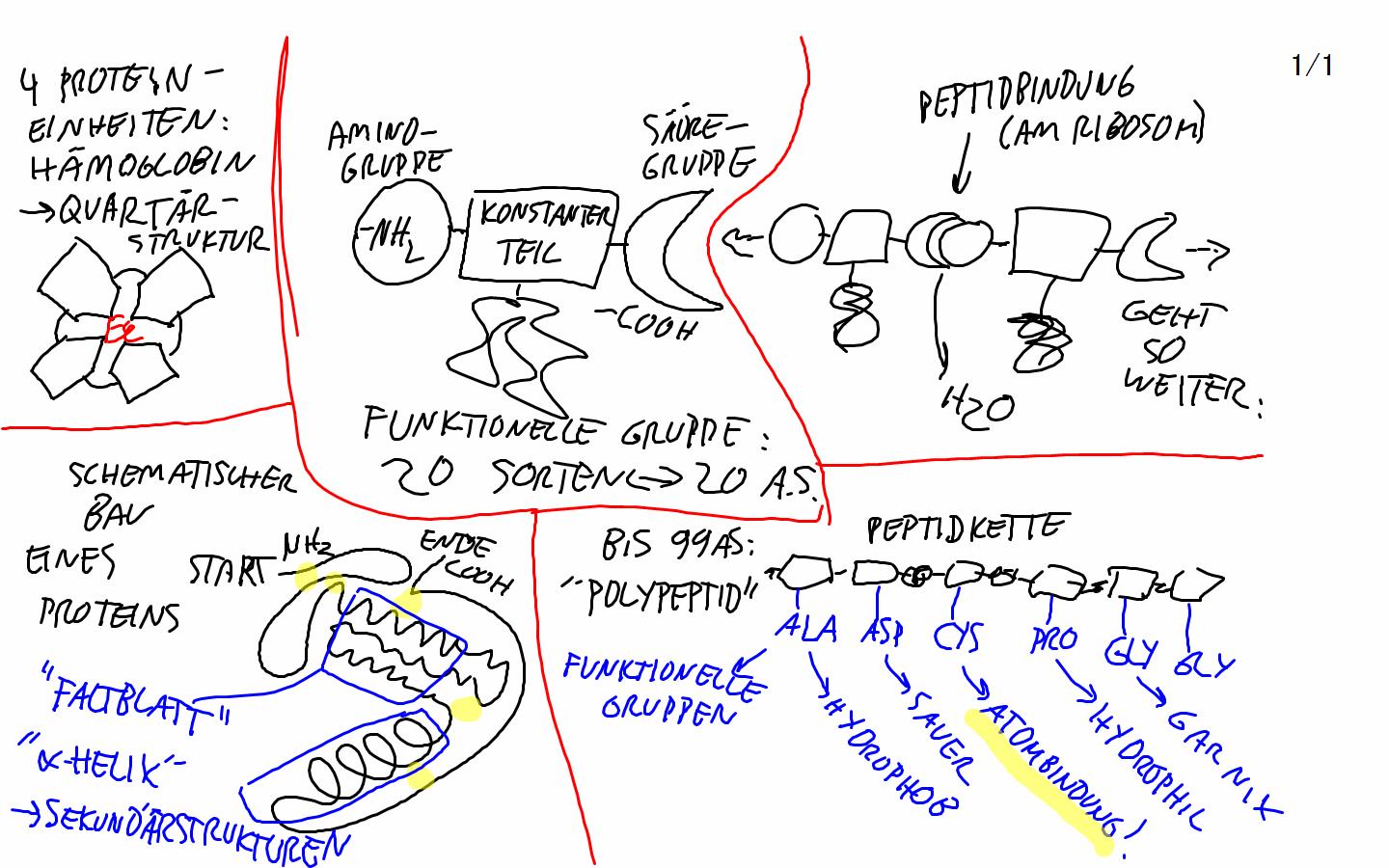
Exkurs 7 Ein Polypeptid zum Lernen ist das Insulinhormon. Es besteht aus zwei Polypeptidsträngen mit 30 bzw 21 AS, die durch zwei Disulfidbrücken (Cystein trifft auf Cystein) zusammengehalten werden: Wegen ungeklärtem Urheber habe ich die Insulin-Grafik nicht ins Internet gestellt (oben die "Peptidkette" und unten das "Ribosom" hat ein Schüler des AG Stuttgart angefertigt, super und danke) Proteine Aufgaben von Proteinen im Körper: 1. Die wichtigsten sind die Proteine, die als Enzyme wirken. 2. Eine besondere Aufgabe nehmen die Immunproteine wahr bei der gezielten Bekämpfung von Fremdkörpern 3. Blutproteine halten den PH-Wert des Blutes konstant, sie wirken als Puffer-Proteine 4. Es gibt auch Gerüstproteine: - Collagen Bindegewebe in Haut und Knochen - Keratin, die Substanz der Haare (Buch S. 47 oben links) (in Schulbüchern nicht erwähnt, weil sie noch nicht schlüssig erforscht sind, sind „Gedächtnisproteine") Proteine sind die Moleküle im Körper mit enormer Vielfalt. Kohlenhydrate und Fette sind da vergleichsweise einförmig. Auch sind Proteine die Moleküle im Körper, die einen präzisen räumlichen Bau haben können und diesen auch bei vielerlei Beanspruchung aufrecht erhalten. Die Ursache der Vielfalt der Proteine: Ein Protein ist im Grundbau ein langer Faden aus mindestens 100 durch Peptidbindung miteinander verknüpften Aminosäuren. (im Schnitt 500 AS, Rekorde gibt es mit 4000 AS in einem Faden) Das ist die Primärstruktur des Proteins, mit der es aus dem Ribosom herauskommt. Da 20 verschiedene Aminosäuren in jeder Reihenfolge im Protein aufeinanderfolgen können, gibt es Billionen von verschiedenen „Sätzen", die jeder eine andere Primärstruktur des Proteins bewirken. (Wir können doch mit 26 Buchstaben auch alle Wörter schreiben, die wir wollen. Bereits ob wir Tau, Tag, Tal oder Tat schreiben, führt zu sehr verschiedenen Begriffen. Und eine Menge Unsinn wird auch geschrieben - es gibt kein Tad und Taf im Deutschen) Die Ursache der Stabilität der Proteine: Bei allen Aminosäuren außer der einfachsten, dem Glycin, ragen „funktionelle Gruppen" aus der Peptidkette, aus dem Faden der Primärstruktur heraus. Und jede Aminosäure ist nicht einfach gradlinig, sondern mit einem typischen Winkel an die vorherige geknüpft. Dieser Winkel lässt sich durch Energieaufwand bewegen, aber im entspannten Zustand kehrt die Aminosäure zu ihrem Winkel zwischen den Nachbar-Aminosäuren zurück. Die funktionellen Gruppen der AS kleben mal aneinander, mal stoßen sie sich ab; 2 x hydrophil = kleb ---> Wasserstoffbrückenbindung 2 x hydrophob = kleb ---> Van-der-Waals-Kräfte-Anziehung sauer + basisch = kleb ---> Ladungsanziehung 2 x Cystein mit Disulfidbrücke = Superkleb ---> Atombindung! hydrophil begegnet hydrophob = Abstoßung sauer begegnet sauer = Abstoßung basisch begegnet basisch = Abstoßung Wir müssen in der Schulbiologie nicht alle 20 Aminosäuren auswendig kennen. Sieben reichen - an denen sich alle Formen des Anziehens und Abstoßens beispielhaft zeigen lassen. Alanin Ala (hydrophob) Serin Ser (hydrophil) Asparaginsäure Asp (sauer) Lysin Lys (basisch) Glycin Gly (einfachst gebaut) (Buch S. 46) Cystein Cys (mit Schwefelatom) Phenylalanin Phe (hydrophob) (Buch S. 47) Zeichnung 1: Zweiteilung: AS konstanter Teil / AS funktionelle Gruppe - klarmachen, dass konstant immer gleich ist. Drunter funktionelle Gruppe einzeichnen. Alanin CH3 Serin OH, Asparaginsäure COOH Lysin NH3 (Glycin hat keine funktionelle Gruppe:-) Cystein -SH Phenylalanin Benzolring Zeichnung 2: Die Peptidbindung verknüpft die konstanten Teile der AS miteinander und lässt die funktionellen Gruppen unverändert. Beim Knüpfen einer Peptidbindung im Ribosom - wird 1 ATP verbraucht zu ADP - wird H2O Wasser abgespalten
Damit die AS aneinanderkleben, müssen sie nicht nebeneinander liegen, sondern einander im räumlichen Bau des Proteins gegenüberliegen. Dieser räumliche Bau des Proteins ist seine Tertiärstruktur. Die Tertiärstruktur baut sich sogleich hinter dem Ribosom auf. Wie ein Ballon, der schrittweise an Form gewinnt, formt sich mit Winkeln, Anziehungen und Abstoßungen das aus dem Ribosom herauswachsende frisch zusammengefügte Protein. Zeichnung anhand DREIER AS - die Mittlere knüpft nach beiden Seiten. „NH3-Ende der Peptidkette" „COOH-Ende der Peptidkette" Viele, nicht alle Proteine haben noch eine Sekundärstruktur. Das sind regelmäßige Abfolgen bestimmter AS, die eine stabile Röhre („Alpha-Helix") oder eine stabile Fläche ("Faltblatt-Struktur") im Protein erzeugen - wie Säulen und Wände. (Buch S. 47) Zeichnung 3 von Helix, 4 von Faltblatt .................. mehrere Proteine können sich auch zu einem „Übermolekül" zusammenlagern. Das Ribosom besteht aus 2 verschiedenen Untereinheiten. Das Hämoglobin (der rote Blutbestandteil) besteht aus vier fast baugleichen Untereinheiten. Diese schaffen es, in ihrer Mitte jeweils ein Eisen-Ion festzuhalten. Und diese vier Eisenionen können 1 Sauerstoffmolekül aufnehmen und wieder abgeben - was die Aufgabe des Hämoglobins ist. Die Zusammenlagerung mehrer Proteine zu einer Funktionseinheit nennt man „Quartärstruktur" Bild vom Hämoglobin S. 47 Sechs mitsamt Erläuterung zu lernende Begriffe bei Enzymen: Bei Aufgaben wie „Abgabe und Aufnahme von Sauerstoff", „Knüpfen einer Peptidbindung" spielen die Proteine (hier Hämoglobin, Ribosom) die Rolle von Katalysatoren. Katalysatoren ermöglichen den Ablauf einer chemischen Reaktion unter möglichst geringem Energieverbrauch. Im Auto z.B. ermöglicht der „Kat" das Zerlegen von giftigen Abgasen in Ungiftige. (NO2 wird zu N2, CO wird zu CO2, unverbrannte Benzinreste werden ganz zu CO2 und H2O verbrannt) Proteine heißen nun 1. Biokatalysatoren. In der Atmungskette (Exkurs 9 an zwei Stellen) stecken etwa 30 Proteine = Biokatalysatoren (recherchieren, für die Atmungskette ruhig nennen... Cytochrom) Jedes enzymatisch wirksame Protein ist dabei 2. substratspezifisch - es wirkt nur auf einen ganz bestimmten Stoff - und 3. wirkungsspezifisch - es bewirkt an einem bestimmten Stoff nur eine bestimmte Veränderung Der „bestimmte Stoff", an dem ein Protein etwas katalysiert = eine chemische Reaktion energiesparend hervorruft, heißt übrigens 4. „Substrat" Die Stelle im räumlichen Bau des Enzyms - in seiner Tertiärstruktur - an der die chemische Veränderung des Substrates stattfindet, heißt 5. „aktives Zentrum". Damit ein Enzym substratspezifisch sich verhalten kann, muss es am aktiven Zentrum genau so gebaut sein, dass eben nur ein Substrat da hineinpasst. Dieses genau Zusammenpassen eines bestimmten Substrates ins aktive Zentrum eines Enzyms nennt man das 6. Schlüssel-Schloss-Prinzip. Auftrag an Schüler: Eigenzeichnung, in der alle 6 Begriffe drin vorkommen. Buch darf aufgeschlagen sein. Buch S. 65 - da stellt man als erstes fest: Viele Enzyme (Proteine mit der Aufgabe „Biokatalysator") haben im Namen die Endung -ase Was ist ein Enzym: Katalase, Katalyse, Nase, Mutase, Isomerase, Isomer, Synthetase, Synthese, Hase, Phosphatase ? Denaturierung von Proteinen - reversibel bei Grenztemperaturen irreversibel bei Schwermetallen |